А.С. Бучнев, А.П. Кулешов, А.А. Дробышев, В.А. Еленкин, Г.А. Шевченко, Н.В. Грудинин
ФГБУ «Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова» Минздрава России, Москва, Российская Федерация
ФГАОУ ВО «Российский университет дружбы народов имени Патриса Лумумбы», Москва, Российская Федераци
Цель работы: провести стендовые испытания и определить рабочий диапазон скорости насоса имплантированной системы обхода левого желудочка сердца для дальнейшей диагностики и лечения пациентов с малыми антропометрическими показателями. Материалы и методы. Исследование осевого насоса проводилось на разработанном нами гидродинамическом стенде, имитирующем сердечно-сосудистую систему и включающем в себя систему измерения и регистрации давлений и расхода, а также программное обеспечение для обработки технических и биомедицинских параметров. Результаты. Рабочий диапазон скорости вращения ротора насоса «СТРИМ КАРДИО» для достижения скорости потока в 2,5 ± 0,5 л/мин при перепаде давления 80 ± 5 мм рт. ст. будет равным 8000 ± 1000 об/мин, при этом потребляемая мощность будет составлять 6,5 ± 1 Вт.
Ключевые слова: сердечная недостаточность, обход левого желудочка сердца, гидродинамический стенд, расход насоса, напор насоса, осевой насос
ВВЕДЕНИЕ
Трансплантация сердца неизменно признается предпочтительным методом лечения людей с сердечной недостаточностью (СН) терминальной стадии [1]. Критическая нехватка донорских органов является одним из множеств ограничений при трансплантации сердца. Несмотря на постоянно расширяющиеся критерии донорства, многие пациенты, которым показана трансплантация сердца, умирают в ожидании органа [2]. В последнее десятилетие накопился большой опыт применения систем вспомогательного кровообращения для лечения СН [3]. Механическая поддержка кровообращения (МПК) с применением устройств помощи левому желудочку сердца первого, второго и третьего поколения становится все более частым методом лечения терминальной стадии СН [4–7].
К устройствам первого поколения относятся системы механической поддержки кровообращения с пневматическим управлением для искусственного желудочка сердца Thoratec (Thoratec Laboratories Corporation, США) и EXCOR (Berlin Heart, Германия), данные системы могут применяться как у взрослых, так и у детей. К основным минусам этих систем относятся экстракорпоральное расположение искусственных желудочков сердца и большие размеры наружных приводов. Устройства такого типа имели ограниченный ресурс работы и невысокую надежность [8].
К устройствам второго поколения относятся насосы роторного типа малопульсирующего потока: HeartAssist (MicroMed Cardiovascular, Houston), Jarvik 2000 FlowMaker (Jarvik heart, Inc., New York), HeartMate II (Thoratec Corporation Pleasanton, CA), АВК-Н (Россия) и «СТРИМ КАРДИО» (Дона-М, Россия). У этих систем небольшие размеры и вес, они бесшумны, относительно недороги, имеют повышенную надежность и ресурс работы [9–11].
К устройствам третьего поколения относятся насосы с электромагнитным приводом. Это прежде всего осевой насос Incor (Berlin Heart AEG), центробежный насос HeartWare HVAD (HeartWare, Inc., Miami Lakes, FL), HeartMate III (Thoratec Inc., Pleasanton, CA), EvaHeart LVAS (Sun Medical Technology Research Corporation, Nagano, Japan), Terumo DuraHeart (Terumo Heart Inc., Ann Arbor, MI) [12–14].
Во многих кардиологических центрах имплантированная механическая поддержка кровообращения для взрослых пациентов стала одним из основных методов лечения терминальной стадии СН. У детей и пациентов с малыми антропометрическими показателями возможности имплантации системы вспомогательного кровообращения часто ограничены небольшой площадью поверхности тела, малым весом и размером грудной полости, недостаточным для имплантации устройства. Так как отечественный педиатрический насос в нашей стране находится на стадии разработки, а для лечения пациентов с низким индексом массы тела в основном имплантируется насос HeartMate III, нами рассматривается возможность использования малогабаритного осевого насоса «СТРИМ КАРДИО» (ООО «ДОНА-М», Россия), обычно применяемого у пациентов с высоким индексом массы тела, но уже при малых потоках крови (2 ± 0,5 л/мин).
Режим управления имплантируемым насосом для вспомогательного кровообращения основан на поддержании заданной скорости вращения ротора (СВР) насоса, что позволяет обеспечить необходимый для жизнедеятельности организма кровоток [15]. Установка значения СВР производится непосредственно во время операции и корректируется на этапах сопровождения и реабилитации пациента [16]. Альтернативным способом получения информации о скорости вращения ротора, перепадах давления на насосе, потоке крови, проходящем через насос, и мощности, потребляемой насосом, является косвенная оценка этих параметров c использованием данных, полученных при регистрации расходно-напорной характеристики (РНХ) насоса [17–20], как отдельно, так и при совместной работе с искусственным желудочком сердца.
В настоящей работе показаны стендовые испытания, в ходе которых получены расходно-напорные, энергетические и гемодинамические характеристики насоса. Данные позволяют определить рабочие диапазоны скоростей осевого насоса, которые помогут выбрать оптимальные параметры СВР в клинической практике для точной оценки, диагностики и лечения пациентов с низким индексом массы тела при обходе левого желудочка сердца.
МАТЕРИАЛЫ И МЕТОД
«СТРИМ КАРДИО» – это роторный насос осевого типа с наружным диаметром 28 мм и массой 120 граммов, длина устройства 60 мм, скорость вращения ротора насоса может варьироваться в диапазоне от 5000 до 10 000 об/мин. Насос способен генерировать поток крови до 10 л/мин. СВР регулируется с помощью блока управления, питающегося от одной аккумуляторной батареи и сетевого адаптера. Система имплантируется в России пациентам, как «мост» к трансплантации, так и на постоянной основе, с 2020 года. Это устройство используется для замещения функции левого желудочка у пациентов с СН. Входная канюля насоса имплантируется в полость левого желудочка через верхушку, а выходная канюля подшивается с восходящей или нисходящей аортой.
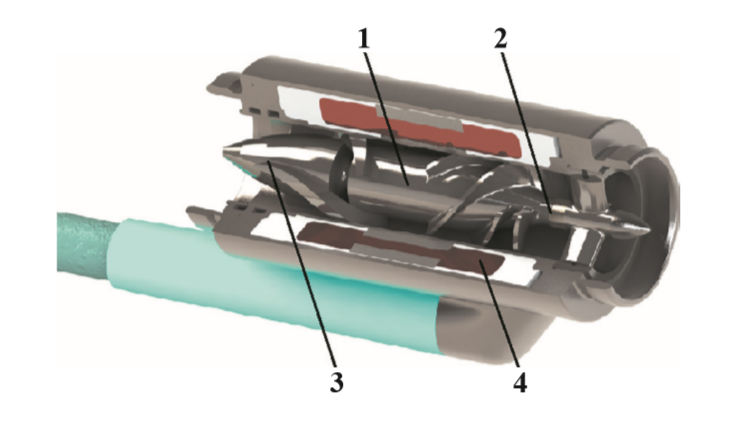
Основным элементом осевого насоса является рабочее колесо с лопатками, которое служит источником передачи энергии вращения потоку крови и определяет направление его вращения (рис. 1). Рабочее колесо с двух сторон установлено в опорах – подшипниках, за лопатками рабочего колеса установлен спрямитель потока, представляющий собой стационарный элемент с лопатками, направление которых противоположно направлению вращающегося потока крови. Таким образом происходит «обратная раскрутка» потока, преобразующая кинетическую энергию вращающего потока в потенциальную энергию давления [21]. Статор электродвигателя постоянного тока интегрирован в корпус насоса, а постоянные магниты двигателя вмонтированы в рабочее колесо.
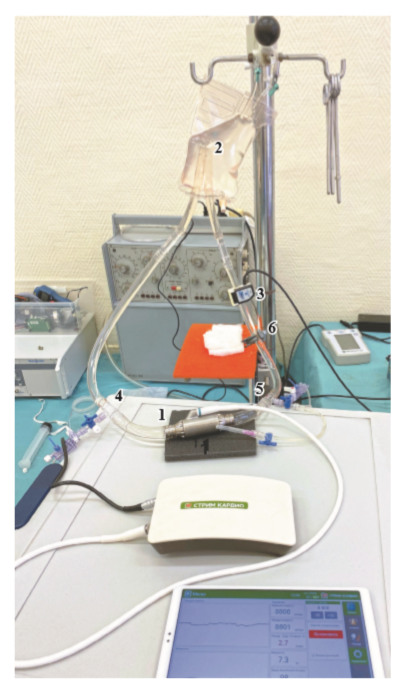
На первом этапе исследований на гидродинамическом стенде (ГС) были получены РНХ для определения рабочего диапазона скоростей при низких потоках крови и мощности осевого насоса (рис. 2).
Гидродинамический стенд состоит из резервуара объемом заполнения 400 мл CAPIOX (Terumo), трубки Tygon (Saint – Gobain, Франция) диаметром 10 мм, гидравлического сопротивления, датчиков давления и расхода. Давление на входе и выходе насоса в ГС измеряли датчиками давления Edwards (Life Sciences). Для измерения системного расхода использовали ультразвуковой датчик расхода Transonic TS402 (Transonic Systems Inc., USA), установленный на выходной магистрали стенда. Измерения давления и расхода контролировались с помощью многоканального модуля «Ангиотон» (Биософт-М, Россия) и визуализировались на ПК программой Pumpax (Биософт-М, Россия). Значения заданной частоты вращения ротора насоса определялись путем изменения давления на входе и выходе насоса при определенном расходе. В дальнейшем для каждого значения заданной СВР насоса строится кривая зависимости расхода от перепада давления.
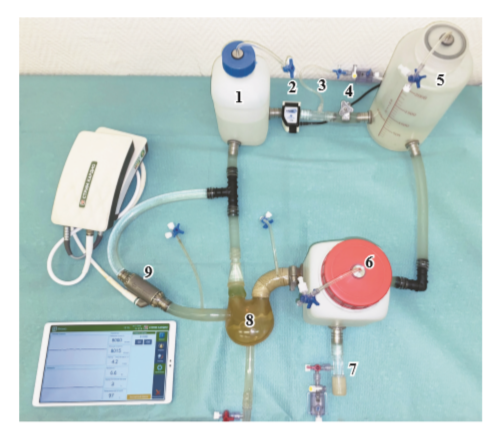
На втором этапе исследований были получены и проанализированы гемодинамические параметры насоса при низких потоках крови в системе обхода левого желудочка сердца (ОЛЖ) на гидродинамическом стенде, имитирующем сердечно-сосудистую систему (ССС) [22].
В качестве параметров модели ССС для большого круга кровообращения использовали такие характеристики, как податливость или эластичность артериального русла, инерционность, общее гидравлическое сопротивление, режим работы имитатора желудочка сердца, имитирующий сократимость левого желудочка сердца, частота сердечных сокращений, соотношение систола/диастола с оценкой их основных гемодинамических параметров (давление и поток). Режим СН задавался изменением давления в искусственном желудочке сердца с системой управления «Синус ИС» (Россия) и периферических сопротивлений без изменения аортальной емкости. При этом были установлены следующие параметры: средний аортальный расход 1 ± 0,3 л/мин, среднее артериальное давление 65 ± 5 мм рт. ст. и среднее давление в левом предсердии 20 ± 1 мм рт. ст. В дальнейшем запускали насос в режиме ОЛЖ для восстановления гемодинамики: расход 2,5 ± 1 л/мин, среднее артериальное давление 80 ± 5 мм рт. ст. и среднее давление в предсердии 5 ± 1 мм рт. ст. Полученные данные были обработаны и сведены в таблицу
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Работа насоса вспомогательного кровообращения напрямую связана с сердечной гемодинамикой. В течение каждого сердечного цикла параметры сократимости меняются в зависимости от физиологических условий, особенно в преднагрузке и постнагрузке, которые приводят к изменению параметров насоса, а именно мощности насоса и потока жидкости, проходящего через него.
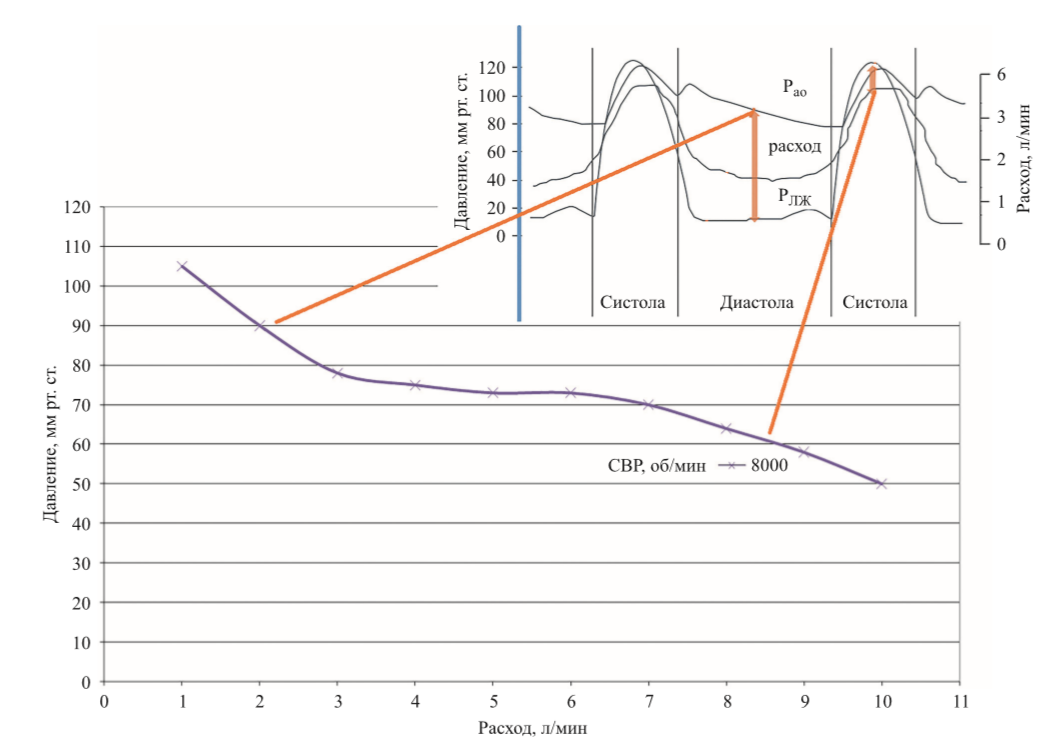
На рис. 4 представлены гидродинамические параметры, полученные на ГС при СВР от 5000 до 10 000 об/мин
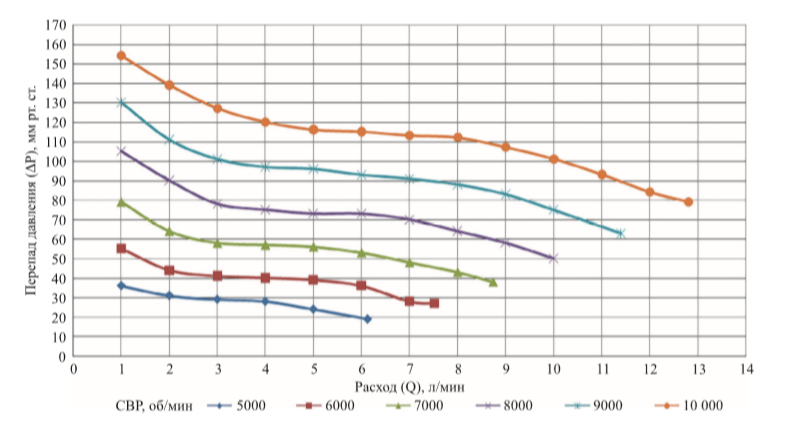
Из полученных кривых перепада давления и расхода можно сделать вывод, что для достижения скорости потока в 2,5 ± 0,5 л/мин СВР насоса «СТРИМ КАРДИО» будет равна 8000 ± 1000 об/мин. Насос «СТРИМ КАРДИО» работает по относительно крутой кривой РНХ, и следовательно, менее чувствителен к изменениям разницы давлений.
Разницу в давлении можно приблизительно оценить как разницу между давлением в левом желудочке и давлением в аорте. Таким образом, поток через насос обратно пропорционален разнице в давлении (рис. 5)
Эта особенность проявляется при каждом сокращении сердца: по мере увеличения разницы в давлении во время диастолы поток насоса уменьшается, а по мере уменьшения разницы в давлении во время систолы поток насоса увеличивается.
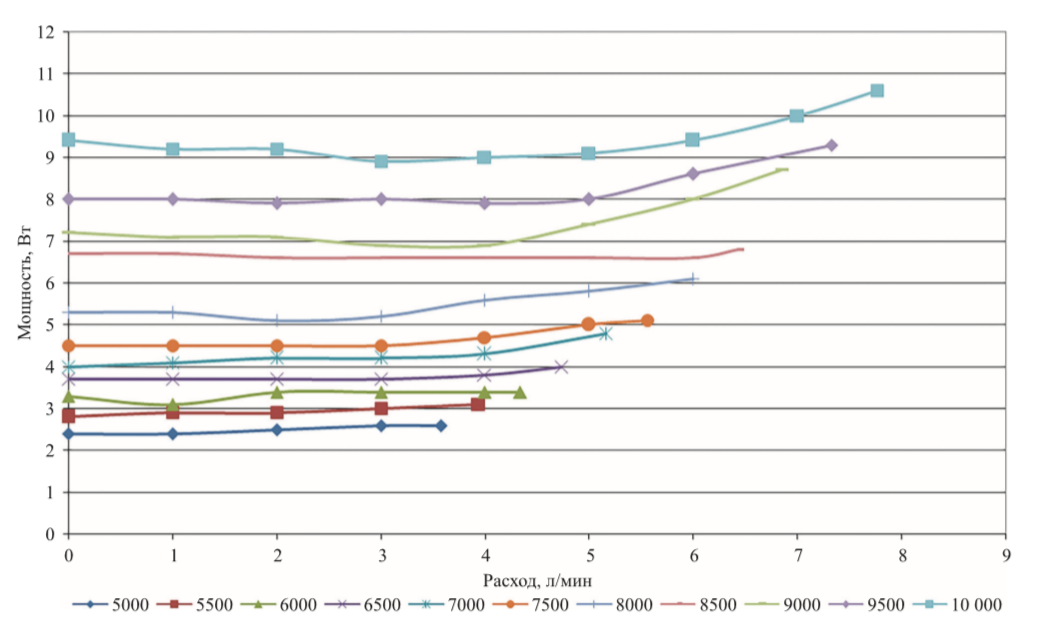
Мощность насоса – это прямой показатель напряжения и силы тока в двигателе насоса, которые могут меняться в зависимости от изменений гемодинамики или патофизиологических нарушений. Например, мощность насоса увеличивается при низких показателях свертываемости крови и тромбозе ротора, хотя это изменение может быть постепенным или резким, а также при изменении условий нагрузки. Это соотношение регулируется в зависимости от установленной СВР насоса (рис. 6).
Конструкция осевого насоса обуславливает ограничения диапазонов скорости и расхода. Для достижения скорости потока в 2,5 ± 0,5 л/мин СВР насоса «СТРИМ КАРДИО» должна быть 8000 ±
1000 об/мин, при этом потребляемая мощность будет составлять 6,5 ± 1 Вт. Низкие показатели энергопотребления насоса позволят снизить вес компонентов системы: блока управления системы и аккумуляторных батарей, тем самым увеличат время автономной работы без замены батарей.
На рис. 7 представлены гемодинамические параметры ССС в режиме сердечной недостаточности и при работе насоса «СТРИМ КАРДИО» в режиме ОЛЖ. Поток при ОЛЖ обеспечивался СВР 8100 ± 50 об/мин, среднее артериальное давление на уровне 80 ± 2 мм рт. ст. и средний аортальный расход 2,5 ± 0,1 л/мин.
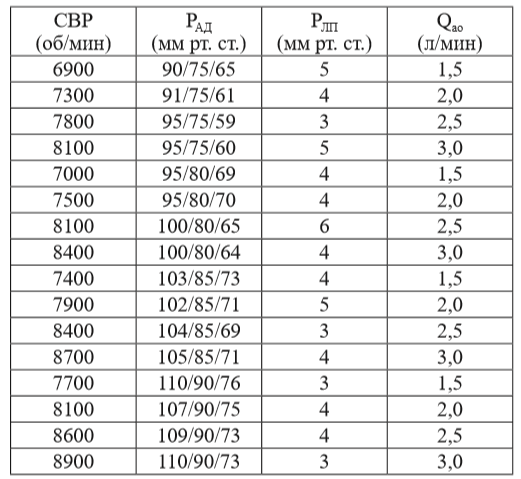
Обобщенные результаты основных гемодинамических показателей для разных значений аортального потока и среднего артериального давления, полученные при определенных СВР насоса в ОЛЖ, показаны в таблице.
По данным таблицы, для достижения скорости потока в 2,5 ± 0,5 л/мин при перепаде давления 80 ± 5 мм рт. ст. СВР насоса «СТРИМ КАРДИО» будет равна 8000 ± 1000 об/мин. Полученные значения СВР насоса в ходе гидродинамических и гемодинамических испытаний при определенном среднем артериальном давлении позволяют косвенно оценить необходимый для жизнедеятельности организма кровоток.
Полученные данные СВР и мощности насоса «СТРИМ КАРДИО» при низких потоках крови в ходе исследований in vitro позволят более точно определить рабочий режим управления насоса в ходе операции обхода левого желудочка сердца пациентам с низким индексом массы тела и скорректировать СВР насоса на этапах сопровождения и реабилитации пациента.
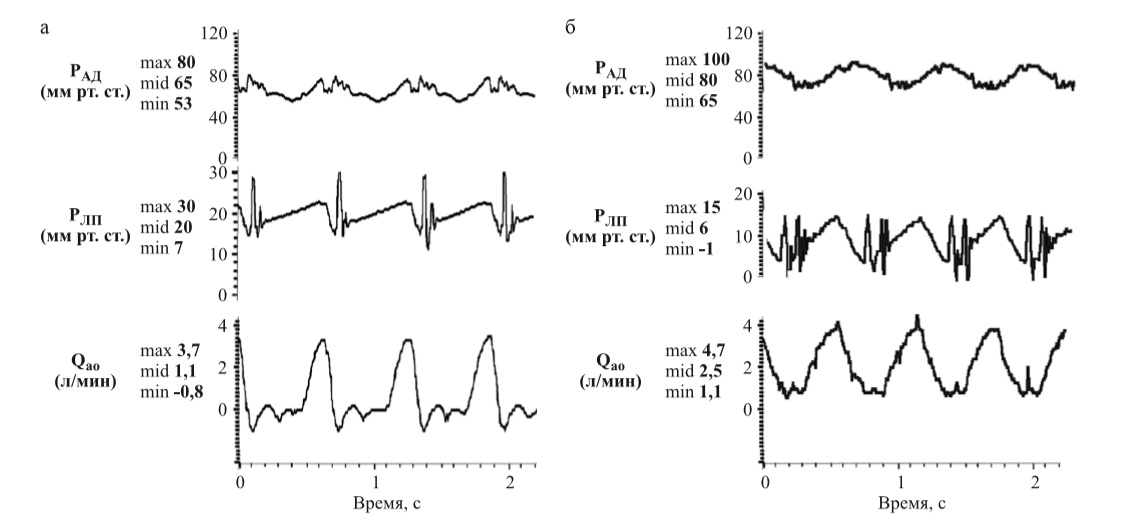
Гемодинамические параметры насоса «СТРИМ КАРДИО» при разных СВР в условиях ОЛЖ
ОБСУЖДЕНИЕ
Насос «СТРИМ КАРДИО» работает по относительно крутой кривой РНХ, и следовательно, менее чувствителен к изменениям разницы давлений, свойственной характеристикам осевым насосам.
Насос имеет небольшие габариты, но при этом обеспечивает требуемую мощность для достижения перепада давления в 80 ± 5 мм рт. ст. при расходе в 2,5 ± 0,5 л/мин.
В режиме обхода левого желудочка сердца при расходе в 2,5 ± 0,5 л/мин скорость вращения ротора насоса «СТРИМ КАРДИО» составила 8000 ± 1000 об/ мин, что сопоставимо со скоростью вращения ротора насоса HeartMate II. С момента одобрения управлением по контролю за продуктами питания и лекарствами США в апреле 2008 года систему Thoratec HeartMate II (Thoratec Corp., Плезантон, Калифорния, США) имплантировали более 27 000 раз [23], в том числе четырем пациентам-подросткам в возрасте от 12 до 15 лет с площадью поверхности тела от 1,5 до 1,7 м2 [24]. Основная задача таких насосов заключается в обеспечении увеличения системного сердечного выброса и снижения нагрузки на желудочек во время сердечного цикла, не приводя к значительным биологическим или гематологическим осложнениям. Полученные гидродинамические и гемодинамические характеристики насоса «СТРИМ КАРДИО» при низких потоках крови наряду с обнадеживающими клиническими результатами имплантации HeartMate II у подростков позволяют сделать вывод о возможном применении «СТРИМ КАРДИО» в клинической практике пациентам с малыми антропометрическими показателями для точной оценки, диагностики и лечения таких больных при обходе левого желудочка сердца.
ЗАКЛЮЧЕНИЕ
В сегодняшней быстро развивающейся медицинской среде крайне важно, чтобы медицинское сообщество оценивало и использовало новые технологии в меру своих возможностей. Программы, берущие на себя задачу оказания поддержки пациентам с сердечной недостаточностью, не поддающейся медикаментозному лечению, должны учитывать множество устройств для надлежащей поддержки такого широкого спектра размеров пациентов и клинических потребностей. Более глубокое понимание взаимосвязи перепада давления и расхода у вспомогательных устройств для обхода левого желудочка сердца при разработке данных систем может привести к улучшению гемосовместимости и гидравлической эффективности. Дальнейшие исследования будут включать в себя испытания насоса «СТРИМ КАРДИО» при малых потоках для определения травмы форменных элементов крови, а также предполагается провести серию экспериментов на животных для исключения тромбообразования в насосе.
Авторы заявляют об отсутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
1. Hunt SA, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG et al. 2009 Focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation. J Am Coll Cardiol. 2009 Apr 14; 53 (15): e1–e90.2. Taylor DO, Stehlik J, Edwards LB, Aurora P, Christie JD, Dobbels F et al. Registry of the International Society for Heart and Lung Transplantation: twenty-sixth official adult heart transplant report – 2009. J Heart Lung Transplant. 2009 Oct; 28 (10): 1007–1022.
3. Slaughter MS, Pagani FD, Rogers JG, Miller LW, Sun B, Russell SD et al. Clinical management of continuousflow left ventricular assist devices in advanced heart failure. J Heart Lung Transplant. 2010 Apr; 29 (4 Suppl): S1–S39.
4. Norman JC, Duncan JM, Frazier OH, Hallman GL, Ott DA, Reul GJ, Cooley DA. Intracorporeal (abdominal) left ventricular assist devices or partial artificial hearts: A five-year clinical experience. Arch Surg. 1981 Nov; 116 (11): 1441–1445.
5. Liotta D, Hall CW, Henly WS, Cooley DA, Crawford ES, Debakey ME. Prolonged assisted circulation during and after cardiac or aortic surgery. prolonged partial left ventricular bypass by means of intracorporeal circulation. Am J Cardiol. 1963 Sep; 12: 399–405.
6. DeBakey ME. Left ventricular bypass pump for cardiac assistance. Clinical experience. Am J Cardiol. 1971 Jan; 27 (1): 3–11.
7. DeBakey ME, Kennedy JH. Mechanical circulatory support: current status. Am J Cardiol. 1971 Jan; 27 (1): 1–2.
8. Oz MC, Rose EA, Levin HR. Selection criteria for placement of left ventricular assist devices. Am Heart J. 1995 Jan; 129 (1): 173–177.
9. Frazier OH, Rose EA, Macmanus Q, Burton NA, Lefrak EA, Poirier VL, Dasse KA. Multicenter clinical evaluation of the HeartMate 1000 IP left ventricular assist device. Ann Thorac Surg. 1992 Jun; 53 (6): 1080–1090.
10. Portner PM, Oyer PE, Pennington DG, Baumgartner WA, Griffith BP, Frist WR et al. Implantable electrical left ventricular assist system: bridge to transplantation and the future. Ann Thorac Surg. 1989 Jan; 47 (1): 142–150.
11. Готье СВ, Иткин ГП, Шемакин СЮ, Саитгареев РШ, Попцов ВН, Захаревич ВМ и др. Первый опыт клинического применения отечественного аппарата вспомогательного кровообращения на базе имплантируемого осевого насоса для двухэтапной трансплантации сердца. Вестник трансплантологии и искусственных органов. 2013; 15 (3): 92–101. Gautier SV, Itkin GP, Shemakin SYu, Saitgareev RSh, Poptsov VN, Zakharevich VM et al. The first experience in clinical application of domestic circulatory support device on basis of implantable axial pump for two stage heart transplantation. Russian Journal of Transplantology and Artificial Organs. 2013; 15 (3): 92–101. [In Russ, English abstract]. doi: 10.15825/1995-1191-2013-3-92-101.
12. Rogers JG, Aaronson KD, Boyle AJ, Russell SD, Milano CA, Pagani FD et al. Continuous flow left ventricular assist device improves functional capacity and quality of life of advanced heart failure patients. J Am Coll Cardiol. 2010 Apr 27; 55 (17): 1826–1834.
13. Pagani FD, Miller LW, Russell SD, Aaronson KD, John R, Boyle AJ et al. Extended mechanical circulatory support with a continuous-flow rotary left ventricular assist device. J Am Coll Cardiol. 2009 Jul 21; 54 (4): 312–321.
14. Kirklin JK, Naftel DC, Kormos RL, Stevenson LW, Pagani FD, Miller MA et al. Second INTERMACS annual report. More than 1,000 primary left ventricular assist device implants. J Heart Lung Transplant. 2010 Jan; 29 (1): 1–10.
15. Stevenson LW, Kormos RL. Mechanical cardiac support 2000: current applications and future trial design. J Heart Lung Transpl. 2001 Jan; 20 (1): 1–38.
16. Иткин ГП, Филатов ИА, Дозоров КН, Адаскин АВ. Косвенные методы определения расхода и напора роторных насосов для крови. Вестник трансплантологии и искусственных органов. 2015; 17 (1): 97–102. Itkin GP, Filatov IA, Dozorov KN, Adaskin AV. Indirect methods of measuring flоw rate and pressure drop of rotary blood pumps. Russian Journal of Transplantology and Artificial Organs. 2015; 17 (1): 97–102. [In Russ, English abstract]. doi: 10.15825/1995-1191-2015-1-97-102.
17. Ayre PJ, Lowell NH, Woodard JC. Non-invasive flow estimation in an implantable rotory pump: a study considering non-pulsatile and pulsatile flow. Phyiol Meas. 2003 Feb; 24 (1): 179–189.
18. Funakibo A, Ahmed S, Sakuma I, Fukui Y. Flow rate and pressure head estimation in a centrifugal blood pump. Artif Organs. 2002 Nov; 26 (11): 985–990.
19. Giridharan GA, Skliar M. Physiological Control of Blood Pumps Using Intrinsic Pump Parameters: a Computer Simulation Study. Artif Organs. 2006 Apr; 30 (4): 301–307.
20. Schima H, Trubel W, Moritz A, Wieselthaler G, Stohr HG, Thoma H et al. Noninvasive monitoring of rotary blood pumps: necessity, possibilities, and limitations. Artif Organs. 1992 Apr;16(2): 195–202.
21. Иткин ГП, Шемакин СЮ, Шохина ЕГ, Бурцев ВИ, Аврамов ПВ, Волкова ЕА и др. Результаты экспериментальных исследований на телятах первого отечественного имплантируемого осевого насоса. Вест ник трансплантологии и искусственных органов. 2013; 15 (3): 49–58. Itkin GP, Shemakin SJu, Shokhina EG, Burcev VI, Avramov PV, Volkova EA et al. The first domestic implantable axial flow pump: results of experimental studies in calves. Russian Journal of Transplantology and Artificial Organs. 2013; 15 (3): 49–58. [In Russ, English abstract]. doi: 10.15825/1995-11912013-3-49-58.
22. Иткин ГП, Бучнев АС, Кулешов АП, Дробышев АА, Сырбу АИ. Гидродинамический стенд для исследования педиатрических систем вспомогательного кровообращения. Медицинская техника. 2022; 1: 5–8. Itkin GP, Buchnev AS, Kuleshov AP, Drobyshev AA, Syrbu AI. A hydrodynamic bench for testing pediatric circulatory support devices. Biomedical Engineering. 2022; 56 (1): 6–10. [In Russ, English abstract]. doi: 10.1007/ s10527-022-10156-9.
23. Maher TR, Butler KC, Poirier VL, Gernes DB. HeartMate left ventricular assist devices: a multigeneration of implanted blood pumps. Artif Organs. 2001 May; 25 (5): 422–426.
24. Owens WR, Bryant R 3rd, Dreyer WJ, Price JF, Morales DL. Initial Clinical Experience with the HeartMate II Ventricular Assist System in a Pediatric Institution. Artif Organs. 2010 Jul; 34 (7): 600–603.
Статья поступила в редакцию 10.02.2025 г.
Бучнев А.С., Кулешов А.П., Дробышев А.А., Еленкин В.А., Шевченко Г.А., Грудинин Н.В. Стендовые исследования малогабаритного осевого насоса для имплантации пациентам с малыми антропометрическими показателями. Вестник трансплантологии и искусственных органов. 2025;27(2):81-88. https://doi.org/10.15825/1995-1191-2025-2-81-88

